Larutan penyangga atau larutan buffer adalah larutan yang dapat mempertahankan pH pada kisarannya. Jika pada suatu larutan penyangga ditambah sedikit asam atau ditambahkan sedikit basa atau diencerkan, maka pH larutan tidak berubah.
1. Larutan Penyangga Asam
Larutan ini dapat mempertahankan pH pada daerah asam (pH < 7). Larutan penyangga asam terdiri dari asam lemah (HA) dan basa konjugasinya (A - ). Larutan ini dapat dibuat dengan mencampurkan larutan asam lemah dengan garamnya. Contoh, larutan penyangga dari campuran asam asetat dengan natrium asetat. Persamaan reaksinya adalah sebagai berikut.
CH 3 COOH (aq) --> CH 3 COO - (aq) + H + (aq)
Larutan ini juga dapat dibuat dari campuran asam lemah dengan basa kuat, dengan catatan basa kuat harus habis bereaksi, sehingga pada akhir reaksi hanya terdapat asam lemah dan garamnya (basa konjugasinya).
CH 3 COOH (aq) + NaOH (aq) --> CH 3 COONa (aq) + H 2 O (l)
HA (aq) --> A - (aq) + H + (aq)
Asam lemah Basa konjugasi
2. Larutan Penyangga Basa
Larutan ini dapat mempertahankan pH pada daerah basa (pH > 7). Larutan penyangga basa terdiri dari basa lemah (B) dan asam konjugasinya (BH + ). Larutan ini bisa dibuat dengan mencampurkan larutan basa lemah dengan garamnya. Contoh, larutan penyangga dari campuran amonia dengan amonium klorida. Persamaan reaksinya adalah sebagai berikut.
NH 3 (aq) + H + (aq) --> NH 4 + (aq)
Larutan ini juga dapat dibuat dari campuran basa lemah dengan asam kuat, dengan catatan asam kuat harus habis bereaksi, sehingga pada akhir reaksi hanya terdapat basa lemah dan garamnya (asam konjugasinya). Persamaan reaksinya adalah sebagai berikut.
NH 3(aq) + HCl (aq) --> NH 4 Cl (aq)
reaksi kesetimbangan pada larutan penyangga adalah sebagai berikut
B (aq) + H 2 O (l) --> BH + (aq) + OH - (aq)
Prinsip kerja larutan penyangga
Sebenarnya penambahan sedikit asam, basa, atau pengenceran pada larutan penyangga menimbulkan sedikit perubahan pH (tetapi besar perubahan pH sangatlah kecil) sehingga pH larutan dianggap tidak bertambah atau pH tetap pada kisarannya. Namun, jika asam atau basa ditambahkan ke larutan bukan penyangga maka perubahan pH larutan akan sangat mencolok.
Prinsip kerja dari larutan penyangga yang dapat mempertahankan harga pH pada kisarannya adalah sebagai berikut.
a. Larutan Penyangga Asam HA/A -
HA (aq) --> A - (aq) + H + (aq)
- Jika ditambah sedikit asam kuat (H + )
Ion H + dari asam kuat akan menaikkan konsentrasi H + dalam larutan, sehingga reaksi kesetimbangan larutan terganggu; reaksi akan bergeser ke kiri. Namun, basa konjugasi (A - ) akan menetralisir H + dan membentuk HA
A - (aq) + H + (aq) → HA (aq)
sehingga pada kesetimbangan yang baru tidak terdapat perubahan konsentrasi H + yang berarti, besarnya pH dapat dipertahankan pada kisarannya.
- Jika ditambah sedikit basa kuat (OH - )
Ion OH - dari basa kuat akan bereaksi dengan H + dalam larutan, sehingga konsentrasi H + menurun dan kesetimbangan larutan terganggu. Oleh karena itu, HA dalam larutan akan terionisasi membentuk H + dan A - ; reaksi kesetimbangan bergeser ke kanan
OH - (aq) + H + (aq) → H 2 O (l)
HA (aq) → A - (aq) + H + (aq)
sehingga, pada kesetimbangan yang baru tidak terdapat perubahan konsentrasi H + yang nyata; pH larutan dapat dipertahankan pada kisarannya. Asam lemah dapat menetralisir penambahan sedikit basa OH - .
HA (aq) + OH - (aq) → A - (aq) + H 2 O (l)
- Jika larutan penyangga diencerkan
Pengenceran larutan merupakan penambahan air (H 2 O) pada larutan. Air (H 2 O) akan mengalami reaksi kesetimbangan menjadi H + dan OH -, namun H 2 O yang terurai sangat sedikit. Jadi, konsentrasi H + dan OH - sangat kecil, sehingga dapat diabaikan.
b. Larutan Penyangga Basa B/BH +
B (aq) + H 2 O (l) --> BH + (aq) + OH - (aq)
- Penambahan sedikit asam kuat (H + )
H + dari asam kuat dapat bereaksi dengan OH - pada larutan, sehingga konsentrasi OH - menurun dan reaksi kesetimbangan akan bergeser ke kiri. Basa lemah (B) dalam larutan akan bereaksi dengan H 2 O membentuk asam konjugasinya dan ion OH - .
H + (aq) + OH - (aq) → H 2 O (l)
B (aq) + H 2 O (l) → BH + (aq) + OH - (aq)
Pada kesetimbangan yang baru tidak terdapat perubahan pH yang nyata, besarnya pH dapat dipertahankan. Basa lemah dapat menetralkan penambahan sedikit asam (H + ).
B (aq) + H + (aq) → BH + (aq)
- Penambahan sedikit basa kuat (OH - )
Adanya basa kuat (OH - ) dapat meningkatkan konsentrasi OH - dalam larutan, sehingga reaksi kesetimbangan akan bergeser ke kiri. Namun adanya asam konjugasi (BH + ) dapat menetralkan kehadiran OH - dan membentuk B dan H 2 O. Sehingga pada kesetimbangan tidak terdapat perubahan konsentrasi OH - yang nyata, dan pH larutan dapat dipertahankan.
BH + (aq) + OH - (aq) → B (aq) + H 2 O (l)
- Penambahan air (pengenceran)
Penambahan H 2 O dalam larutan akan langsung terionisasi menjadi H + dan OH -, namun konsentrasi H + dan OH - sangat kecil, sehingga dapat diabaikan.
Larutan penyangga asam
pH larutan penyangga asam tergantung pada tetapan ionisasi asam lemah (Ka) dan perbandingan konsentrasi asam dengan konsentrasi basa konjugasinya, contoh larutan penyangga asam adalah campuran dari larutan asam asetat (CH 3 COOH) dan larutan natrium asetat (CH 3 COONa), asam asetat akan terionisasi sebagian, sedangkan natrium asetat akan terionisasi sempurna. Jika terdapat a mol asam asetat dan g mol natrium asetat, maka susunan reaksinya sebagai berikut.
CH 3 COOH (aq) D CH 3 COO - (aq) + H + (aq)
Mula-mula a - - mol
Reaksi -α +α +α mol
Akhir a- α α α mol
CH 3 COONa (aq) → CH 3 COO - (aq) + Na + (aq)
Mula-mula g - - mol
Reaksi -g +g +g mol
Akhir - g g mol
Akhir - g g mol
Reaksi kesetimbangan asam asetat mempunyai harga tetapan ionisasi (Ka) adalah:
sehingga
Berdasarkan kedua reaksi di atas, persamaan tetapan ionisasi Ka, ion CH 3 COO - berasal dari garam dapat mendorong kesetimbangan menuju ke arah kiri, sehingga jumlah mol CH 3 COOH bertambah. Jumlah CH 3 COOH yang terionisasi sebesar (a - α) mol dan jumlah ion CH 3 COO - adalah (g + α) mol. Namun karena α sangat kecil nilai α diabaikan, sehingga mol CH 3 COOH = a mol dan mol CH 3 COO - = g mol.
Dengan demikian, persamaan di atas dapat ditulis:
dengan V = volume larutan
Keterangan:
Ka = tetapan ionisasi asam
a = jumlah mol asam penyangga
g = jumlah mol basa konjugasi (garam)
Larutan penyangga basa
pH larutan penyangga basa bergantung pada tetapan ionisasi basa (Kb), dan perbandingan konsentrasi basa (lemah) dengan konsentrasi asam konjugasinya. Contoh larutan penyangga basa adalah campuran dari gas amonia (NH 3 ) dengan larutan amonium klorida (NH 4 Cl).
Amonia merupakan basa lemah, sehingga hanya terionisasi sebagian, sedangkan amonium klorida akan terionisasi sempurna. Jika terdapat b mol amonia dan g mol amonium klorida, maka susunan reaksinya dapat ditulis sebagai berikut.
NH 3 (aq) + H 2 O (l) --> NH 4 + (aq) + OH - (aq)
Mula-mula b - - mol
Reaksi -α +α +α mol
Reaksi -α +α +α mol
Akhir (b-α) α α mol
NH 4 Cl (aq) --> NH 4 + (aq) + Cl - (aq)
Mula-mula g - - mol
Reaksi -g +g +g mol
Reaksi -g +g +g mol
Akhir - g g mol
Pada reaksi kesetimbangan amonia, harga tetapan ionisasi basa adalah sebagai berikut.
sehinggaBerdasarkan kedua reaksi di atas, NH 4 + dari amonium klorida akan menggeser kesetimbangan amonium, sehingga reaksi bergeser ke kiri dengan jumlah mol NH 4 + bertambah dari g menjadi (g + α) mol dan mol NH 3 dari b menjadi (b – α) mol. Karena besarnya α sangat kecil, maka pertambahan jumlah mol NH 4 + dan NH 3 diabaikan, sehingga mol NH 3 = b mol, dan mol NH 4 + = g mol. Dengan demikian, persamaannya dapat ditulis:
dengan V: volume larutandengan dasar pH = 14 -pOH, maka
Fungsi larutan penyangga
Larutan penyangga sangat penting dalam kehidupan; misalnya dalam analisis kimia, biokimia, bakteriologi, zat warna, fotografi, dan industri kulit. Dalam bidang biokimia, kultur jaringan dan bakteri mengalami proses yang sangat sensitif terhadap perubahan pH. Darah dalam tubuh manusia mempunyai kisaran pH 7,35 sampai 7,45, dan apabila pH darah manusia di atas 7,8 akan menyebabkan organ tubuh manusia dapat rusak, sehingga harus dijaga kisaran pHnya dengan larutan penyangga.
Darah Sebagai Larutan Penyangga
Ada beberapa faktor yang terlibat dalam pengendalian pH darah, diantaranya penyangga karbonat, penyangga hemoglobin dan penyangga fosfat.
a. Penyangga Karbonat
Penyangga karbonat berasal dari campuran asam karbonat (H 2 CO 3 ) dengan basa konjugasi bikarbonat (HCO 3 ).
H 2 CO 3 (aq) --> HCO 3(aq) + H + (aq)
Penyangga karbonat sangat berperan penting dalam mengontrol pH darah. Pelari maraton dapat mengalami kondisi asidosis, yaitu penurunan pH darah yang disebabkan oleh metabolisme yang tinggi sehingga meningkatkan produksi ion bikarbonat. Kondisi asidosis ini dapat mengakibatkan penyakit jantung, ginjal, diabetes miletus (penyakit gula) dan diare. Orang yang mendaki gunung tanpa oksigen tambahan dapat menderita alkalosis, yaitu peningkatan pH darah. Kadar oksigen yang sedikit di gunung dapat membuat para pendaki bernafas lebih cepat, sehingga gas karbondioksida yang dilepas terlalu banyak, padahal CO 2 dapat larut dalam air menghasilkan H 2 CO 3 . Hal ini mengakibatkan pH darah akan naik. Kondisi alkalosis dapat mengakibatkan hiperventilasi (bernafas terlalu berlebihan, kadang-kadang karena cemas dan histeris).
b. Penyangga Hemoglobin
Pada darah, terdapat hemoglobin yang dapat mengikat oksigen untuk selanjutnya dibawa ke seluruh sel tubuh. Reaksi kesetimbangan dari larutan penyangga oksi hemoglobin adalah:
HHb + O 2 (g) « HbO 2 - + H +
Asam hemoglobin ion aksi hemoglobin
Keberadaan oksigen pada reaksi di atas dapat memengaruhi konsentrasi ion H +, sehingga pH darah juga dipengaruhi olehnya. Pada reaksi di atas O 2 bersifat basa. Hemoglobin yang telah melepaskan O 2 dapat mengikat H + dan membentuk asam hemoglobin. Sehingga ion H + yang dilepaskan pada peruraian H 2 CO 3 merupakan asam yang diproduksi oleh CO 2 yang terlarut dalam air saat metabolisme.
c. Penyangga Fosfat
Pada cairan intra sel, kehadiran penyangga fosfat sangat penting dalam mengatur pH darah. Penyangga ini berasal dari campuran dihidrogen fosfat (H 2 PO 4 - ) dengan monohidrogen fosfat (HPO 3 2- ).
H 2 PO 4 - (aq) + H + (aq) --> H 2 PO 4(aq)
H 2 PO 4 - (aq) + OH - (aq) --> HPO 4 2- (aq) ) + H 2 O (aq)
Penyangga fosfat dapat mempertahankan pH darah 7,4. Penyangga di luar sel hanya sedikit jumlahnya, tetapi sangat penting untuk larutan penyangga urin.
Air Ludah sebagai Larutan Penyangga
Gigi dapat larut jika dimasukkan pada larutan asam yang kuat. Email gigi yang rusak dapat menyebabkan kuman masuk ke dalam gigi. Air ludah dapat mempertahankan pH pada mulut sekitar 6,8. Air liur mengandung larutan penyangga fosfat yang dapat menetralisir asam yang terbentuk dari fermentasi sisa-sisa makanan.
Menjaga keseimbangan pH tanaman.
Suatu metode penanaman dengan media selain tanah, biasanya ikerjakan dalam kamar kaca dengan menggunakan mendium air yang berisi zat hara, disebut dengan hidroponik . Setiap tanaman memiliki pH tertentu agar dapat tumbuh dengan baik. Oleh karena itu dibutuhkan larutan penyangga agar pH dapat dijaga.
Larutan Penyangga pada Obat-Obatan
Asam asetilsalisilat merupakan komponen utama dari tablet aspirin, merupakan obat penghilang rasa nyeri. Adanya asam pada aspirin dapat menyebabkan perubahan pH pada perut. Perubahan pH ini mengakibakan pembentukan hormon, untuk merangsang penggumpalan darah, terhambat; sehingga pendarahan tidak dapat dihindarkan. Oleh karena itu, pada aspirin ditambahkan MgO yang dapat mentransfer kelebihan asam.

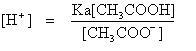




























0 komentar:
Posting Komentar