Mengapa logam perak dapat melapisi peralatan makan? Mengapa baterai dapat digunakan sebagai sumber arus?
Untuk melapisi peralatan makan dengan logam perak digunakan suatu sel yang dinamakan sel elektrokimia melalui proses penyepuhan. Begitu juga dengan baterai, di dalamnya terdapat suatu sel elektrokimia sehingga baterai dapat dijadikan sebagai sumber arus listrik.
Dalam sel elektrokimia berlangsung proses elektrokimia, yaitu suatu reaksi kimia menghasilkan arus listrik atau sebaliknya, arus listrik menyebabkan berlangsungnya reaksi kimia. Oleh karena itu, sel elektrokimia dapat digunakan secara luas dalam kehidupan sehari-hari (tidak hanya untuk penyepuhan logam dan baterai) misalnya pemurnian logam emas dan tembaga, penggunaan sel diafragma, serta accu.
Mengapa sel elektrokimia dapat menghasilkan arus listrik atau sebaliknya?
Dalam sel elektrokimia terdapat hubungan antara reaksi kimia dengan energi listrik. Akibatnya sel elektrokimia dapat menghasilkan arus listrik maupun sebaliknya.Reaksi yang terjadi dalam sel elektrokimia adalah reaksi reduksi dan reaksi oksidasi (reaksi redoks). Reaksi redoks dapat berlangsung jika dalam sel elektrokimia terdapat zat/larutan elektrolit yang dapat mernghantarkan arus listrik. Dalam sel elektrokimia, selain elektrolit juga membutuhkan tempat berlangsungnya reaksi yang dikenal sebagai elektroda. Elektroda dalam sel elektrokimia dibagi menjadi dua yaitu elektroda tempat terjadinya reaksi oksidasi disebut anoda dan elektroda tempat terjadinya reaksi reduksi disebut katoda.
Ada berapa macamkah sel elektrokimia itu? Bagaimanakah reaksi yang terjadi di dalamnya? Adakah perbedaan antara sel elektrokimia satu dengan lainnya?
Berdasarkan keberlangsungan reaksi sel elektrokimia dibagi menjadi dua yaitu sel volta dan sel elektrolisis. Pada sel volta yang sedang digunakan, berlangsung suatu reaksi kimia yang menghasilkan arus/energi listrik. Sedangkan penggunaan energi listrik untuk melangsungkan reaksi kimia disebut sel elektrolisis. Perbedaan Pokok antara Sel Volta dan Sel Elektrolisis adalah sebagai berikut:
Sel Volta, terjadi pada reaksi redoks yang bersifat spontan (bereaksi dengan sendirinya) dan menghasilkan arus listrik. Dalam reaksi sel, perbedaan energi potensial kimia antara reaktan yang lebih tinggi energinya dan produk yang lebih rendah energinya menghasilkan arus listrik. Dengan kata lain sistem bekerja pada lingkungan . Katoda merupakan kutub positif dan anoda kutub negatif. Jadi dalam sel Volta energi kimia diubah menjadi energi listrik.
Sel Elektrolisis, terjadi pada reaksi redoks yang tidak spontan, sehingga untuk melakukan reaksi diperlukan energi. Energi yang diperlukan dalam sel elektrolisis adalah energi listrik dengan arus searah. Untuk berlangsungnya proses elektrolisis diperlukan adanya elektroda, larutan elektrolit, dan sumber arus listrik searah. Dalam sel elektrolisis katoda dihubungkan dengan kutub (-), dan anoda dihubungkan dengan kutub (+) sumber arus. Apabila arus listrik dialirkan ke dalam elektrolit, maka kation akan mengalami reduksi dengan menangkap elektron dan anion akan mengalami oksidasi dengan melepas elektron.
Untuk memudahkan kalian dalam memahami perbedaan dan persamaan antara sel volta dan sel elektrolisis, perhatikan gambar 3 berikut!
v Pada sel elektrokimia baik sel Volta maupun sel elektrolisis digunakan elektrode, yaitu katode, anode, dan larutan elektrolit
v Reaksi yang terjadi pada kedua sel tersebut adalah reaksi redoks. Pada katode terjadi reduksi dan pada anode terjadi oksidasi.
Sel volta
Bagaimanakah prinsip kerja sel volta sehingga dapat menghasilkan energi listrik?
Sel volta merupakan sel elektrokimia yang berlangsung spontan dengan menghasilkan energi listrik. Dalam sel volta, energi listrik dihasilkan dengan jalan pelepasan elektron pada suatu elektroda (oksidasi) dan penerimaan elektron pada elektroda lainnya (reduksi). Elektroda yang melepaskan elektron akan membentuk kutub negatif (-) dinamakan anoda, sedangkan elektroda yang menerima elektron akan membentuk kutub positif (+) dinamakan katoda. Jadi, sebuah sel volta terdiri dari dua bagian atau dua elektroda dimana setengah reaksi oksidasi berlangsung pada anoda dan setengah reaksi berlangsung pada katoda.
Misalkan logam Zn dan Cu dicelupkan ke dalam larutan elektrolit CuSO4 dan kemudian keduanya dihubungkan dengan kawat membentuk rangkaian sel volta sederhana. Apa yang akan terjadi? Perhatikan gambar 4 berikut!
Adanya perbedaan rapat muatan logam Zn dan Cu memungkinkan timbulnya aliran elektron dari Zn ke Cu melalui rangkaian luar pada sel volta. Apabila Zn dan Cu dicelupkan ke dalam larutan elektrolit atau air, maka ion-ion positif Zn2+ dan Cu2+ akan meninggalkan lempeng menuju larutan/air. Sedangkan elektron akan tertinggal di dalam lempeng. Ion-ion Zn2+ yang menuju larutan/air lebih banyak dari ion-ion Cu2+ yang menuju larutan/air. Dapat dikatakan bahwa Zn lebih mudah teroksidasi dibandingkan Cu (Simak deret volta). Akibatnya, elektron yang tertinggal di lempeng Zn lebih banyak dibandingkan elektron yang tertninggal di lempeng Cu. Dapat dikatakan bahwa rapat muatan Zn lebih besar dari lempeng Cu.
Adanya perbedaan rapat muatan menimbulkan perbedaan potensial antara kedua logam tersebut. Beda potensial ini memungkinkan elektron mengalir dari Zn ke Cu melalui rangkaian luar (kawat). Beda potensial antara logam Zn dan Cu tersebut dikenal sebagai gaya gerak listrik (ggl) atau electromotive force(emf).
Pada rangkaian di samping, logam Zn dan Cu disebut elektroda. Zn melepaskan elektroda (teroksidasi) membentuk elektrode negatif atau anode. Sedangkan Cu menerima elektron (tereduksi) membentuk elektrode positif atau katode.
Disini kalian dapat melihat bahwa telah terjadi transfer elektron melalui rangkaian luar sel. Oleh karena setiap e- membawa muatan listrik, maka dapat dikatakan reaksi redoks spontan telah menghasilkan arus listrik.
Namun, aliran elektron yang terjadi akan berlangsung sesaat dan kemudian berhenti. Dengan kata lain, tidak ada beda potensial lagi. Hal ini dikarenakan katode logam Cu telah dilapisi endapan Cu sebagai akibat reaksi reduksi Cu. Akibatnya, terjadi penumpukan muatan e- pada katode sehingga aliran elektron terhenti. Untuk mengatasi keadaan tersebut, sel dibagi menjadi dua setengah sel yang dihubungkan dengan selaput berpori atau jembatan garam.

Bagaimanakah rangkaian sel volta sehingga dapat menghasilkan arus listrik?
Perhatikan rangkaian sel volta pada gambar 10. pada rangkaian, logam Zn dicelupkan ke dalam larutan elektrolit ZnSO4 sementara logam Cu ke dalam larutan CuSO4. kedua logam kemudian dihubungkan dengan suatu rangkaian luar berupa kawat. Reaksi redoks spontan yang terjadi pada sel dapat dijelaskan sebagai berikut.

Pada anode, Zn teroksidasi menjadi ion Zn2+ kemudian pergi menuju larutan dan bereaksi dengan ion SO42-. Muatan elektron (e-) yang tinggal di anode akan mengalir melalui kawat menuju katode. Di katode, e- akan ditangkap oleh ion Cu2+ dalam larutan. Akibatnya, ion Cu2+ mengendap sebagai logam Cu pada permukaan katode.
Selama proses berlangsung, ion Zn2+ yang terbentuk akan pergi ke larutan ZnSO4. hal ini menyebabkan penumpukan ion positif Zn2+ dalam larutan. Akibatnya, larutan menjadi bermuatan positif, dan pada akhirnya ion Zn2+ tidak dapat lagi meninggalkan anode. Sementara itu, pada saat yang bersamaan di katode, perginya ion Cu2+ dari larutan CuSO4 ke katode untuk mengikat elektron dan mengendap, menyebabkan terjadinya penumpukan ion negatif SO42-. Kedua hal tersebut menyebabkan aliran elektron pada rangkaian luar akan terhenti. Untuk mengatasi hal ini, digunakan suatu rangkaian dalam, yakni jembatan garam. Jembatan garam mengandung ion-ion positif dan negatif yang berfungsi menetralkan muatan positif dan negatif dalam larutan elektrolit.
Aplikasi sel volta
Rangkaian sel volta dengan jembatan garam, jarang ditemui dalam kehidupan sehari-hari. Hal ini antara lain karena elektrolitnya berupa larutan yang dapat tumpah atau bocor. Sel volta yang digunakan saat ini dapat dikelompokkan menjadi tiga macam, yakni sel primer, sel sekunder, dan sel bahan bakar.
Sel primer (nonrechargeable)
Sel Kering: Zn – C (Seng – Karbon)
Ditemukan 1860-an dengan nama sel kering, atau sel Leclanche dan lebih familiar dalam kehidupan sehari-hari sebagai baterai biasa.
Baterai ini terdiri dari selongsong (wadah) seng (Zn) yang berfungsi sebagai anoda dari campuran MnO2 dan pasta elektrolit yang terdiri dari NH4Cl, ZnCl2, H2O, dan pati. Sedangkan katodanya adalah batang grafit (tidak aktif). Serbuk grafit ditambahkan untuk meningkatkan aliran (konduktivitas). Pada baterai ini anoda merupakan kutup positif
Sel kering sebenarnya tidak sama sekali kering, disebut sel kering karena elektrolitnya berbentuk pasta (bukan cair).
Reaksi di Anoda (Oksidasi):
Zn(s) → Zn2+(aq) + 2e-
Reaksi di Katoda (Reduksi):
 Reaksi di katoda lebih kompleks dan kurang lengkap untuk dimengerti. MnO2(s) direduksi menjadi Mn2O3(s) melalui sederet tahapan yang melibatkan terbentuknya Mn2+ dan reaksi asam-basa antara NH4+ dan OH-.
Reaksi di katoda lebih kompleks dan kurang lengkap untuk dimengerti. MnO2(s) direduksi menjadi Mn2O3(s) melalui sederet tahapan yang melibatkan terbentuknya Mn2+ dan reaksi asam-basa antara NH4+ dan OH-.2MnO2(s) +2NH4+(aq) +2e- →Mn2O3(s) +2NH3(aq) +H2O(l)
Amoniak yang dihasilkan selain menjadi gas, juga membentuk kompleks dengan Zn2+ dan membentuk kristal jika kontak dengan ion Cl-:
Zn2+(aq) + 2NH3(aq) + Cl-(aq) → Zn(NH3)2Cl2(s)
Reaksi keseluruhan dalam sel:
2MnO2(s)+2NH4Cl(aq)+Zn(s)→Zn(NH3)2Cl2(s)+H2O(l)
+Mn2O3(s) Esel = 1,5 Volt
Penggunaan: radio (jinjing, portable), lampu senter, mainan (anak-anak);
Kekuatan: murah, mudah dibawa/ disimpan, dapat diperoleh/dibentuk dalam berbagai ukuran;
Kelemahan : pada (pengeluaran) arus yang tinggi mengeluarkan air, membebaskan gas amoniak [NH3(g)], yang menyebabkan turunnya tegangan (voltage drop). Sel kering mempunyai waktu hidup relatif pendek karena anoda seng (Zn) bereaksi dengan ion NH4+(aq) yang bersifat asam, dan tidak dapat dimuati/diisi kembali (nonrechargeable).
 Baterai alkaline merupakan hasil modifikasi dari sel kering. Perbedaannya terletak pada jenis elektrolitnya. Setengah reaksinya mempunyai dasar atau prinsip yang sama, tetapi elektrolit yang digunakan adalah pasta kalium hidroksida (KOH atau NaOH). Senyawa tersebut menggantikan fungsi NH4Cl pada baterai biasa. Seng berfungsi sebagai anoda, sedangkan katodanya adalah MnO2. Pada baterai biasa anoda sengnya mudah mengalami korosi karena seng bereaksi dengan ion H+ membentuk ion Zn2+ dan gas H2. Akibatnya baterai bisa mempunyai umur atau masa pakai yang relatif singkat.
Baterai alkaline merupakan hasil modifikasi dari sel kering. Perbedaannya terletak pada jenis elektrolitnya. Setengah reaksinya mempunyai dasar atau prinsip yang sama, tetapi elektrolit yang digunakan adalah pasta kalium hidroksida (KOH atau NaOH). Senyawa tersebut menggantikan fungsi NH4Cl pada baterai biasa. Seng berfungsi sebagai anoda, sedangkan katodanya adalah MnO2. Pada baterai biasa anoda sengnya mudah mengalami korosi karena seng bereaksi dengan ion H+ membentuk ion Zn2+ dan gas H2. Akibatnya baterai bisa mempunyai umur atau masa pakai yang relatif singkat. Reaksi di anoda (oksidasi):
Zn(s) + OH-(aq) → ZnO(s) + H2O(l) + 2e-
Reaksi di katoda (reduksi):
MnO2(s)+ H2O(l)+2e- → Mn(OH)2(s)+2OH-(aq)
Reaksi sel keseluruhan:
Zn(s) + OH-(aq) MnO2(s) + H2O(l) →
ZnO(s) + Mn(OH)2(s) Esel = 1,5 V
• Penggunaan: sama dengan sel kering
• Keuntungan: tidak (jarang) terjadi voltage drop, waktu hidup lebih panjang dibanding sel kering, berbagai ukuran, mudah disimpan/dibawa
• Kelemahan: lebih mahal daripada sel kering
 Baterai merkuri oksida dan perak oksida sangat mirip, keduanya menggunakan seng sebagai anoda (agen pereduksi) dalam medium yang bersifat basa. Dalam baterai merkuri oksida, maka HgO bertindak sebagai katoda, sedang dalam perak oksida sebagai katodanya adalah Ag2O. Pereaksi padatan (zat padat) bersifat kompak dan dipisahkan dengan KOH, dengan pemisah berpori (porous separator). Separator ini berfungsi sangat mirip dengan jembatan garam.
Baterai merkuri oksida dan perak oksida sangat mirip, keduanya menggunakan seng sebagai anoda (agen pereduksi) dalam medium yang bersifat basa. Dalam baterai merkuri oksida, maka HgO bertindak sebagai katoda, sedang dalam perak oksida sebagai katodanya adalah Ag2O. Pereaksi padatan (zat padat) bersifat kompak dan dipisahkan dengan KOH, dengan pemisah berpori (porous separator). Separator ini berfungsi sangat mirip dengan jembatan garam. Reaksi di anoda (oksidasi):
Zn(s) + OH-(aq) → ZnO(s) + H2O(l) + 2e-
Reaksi di katoda (reduksi):
HgO (s) + H2O(l) + 2e- → Hg(l) + 2OH-(aq) (untuk baterai merkuri)
Ag2O (s) + H2O(l) + 2e- → 2Ag(s) + 2OH-(aq) (untuk baterai perak)
Reaksi sel keseluruhan:
Zn(s) + HgO (s) → ZnO(s) + Hg(l) Esel = 1,3 V (baterai merkuri)
Zn(s) + 2AgO (s) → ZnO(s) + 2Ag(l) Esel = 1,6 V (baterai perak)
• Penggunaan: baterai merkuri (untuk arloji, kalkulator), baterai perak (untuk kamera, pengukur detak jantung, alat bantu dengar)
• Keutungan: keduanya berukuran (sangat) kecil dan tipis, tegangan relatif besar. Sel perak relatif kokoh dan non toksik
• Kelemahan: sel merkuri berifat toksik sedang sel perak relatif mahal
Sel sekunder (rechargeable)
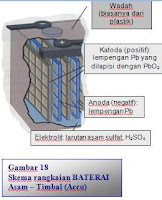
 Suatu contoh betarai timbal-asam yang khas adalah aki (mobil) 12 V yang mempunyai 6 sel terhubung secara seri, dimana setiap sel membebaskan tegangan sekitar 2,1 V. Setiap sel mengandung 2 lempeng (kisi, batang) yang terdiri dari lempeng Pb (sebagai anoda, -) dan PbO2 (sebagai katoda, +). Kedua lempeng dicelupkan dalam suatu larutan elektrolit, ~ 4,5 M H2SO4. Diantara kedua lempeng disekat/dipisahkan dengan nonkonduktor yang terbuat dari fiberglass atau plastik. Sel ini dapat diisi kembali (rechargable). Jika sel digunakan (discharge) akan membebas-kan energi listrik sebagai sel volta (voltaic cell). Sebaliknya saat diisi/dimuati (recharge) akan terjadi pengisian energi (muatan listrik).
Suatu contoh betarai timbal-asam yang khas adalah aki (mobil) 12 V yang mempunyai 6 sel terhubung secara seri, dimana setiap sel membebaskan tegangan sekitar 2,1 V. Setiap sel mengandung 2 lempeng (kisi, batang) yang terdiri dari lempeng Pb (sebagai anoda, -) dan PbO2 (sebagai katoda, +). Kedua lempeng dicelupkan dalam suatu larutan elektrolit, ~ 4,5 M H2SO4. Diantara kedua lempeng disekat/dipisahkan dengan nonkonduktor yang terbuat dari fiberglass atau plastik. Sel ini dapat diisi kembali (rechargable). Jika sel digunakan (discharge) akan membebas-kan energi listrik sebagai sel volta (voltaic cell). Sebaliknya saat diisi/dimuati (recharge) akan terjadi pengisian energi (muatan listrik).Reaksi di anoda (oksidasi):
Pb(s) + HSO4-(aq) → PbSO4(s) + H+(aq) + 2e-
Reaksi di katoda (reduksi):
PbO2(s) + H+(aq) + HSO4-(aq) + 2e- → PbSO4(s) + 2H2O(l)
Kedua setengah-reaksi menghasilkan ion Pb2+, satu melalui oksidasi Pb, yang lain melalui reduksi PbO2. Ion Pb2+ membentuk PbSO4(s) di kedua elektroda melalui reaksinya dengan HSO4-.
Reaksi sel keseluruhan (saat discharge) adalah:
Pb(s) + PbO2(s) + H2SO4 (aq) → PbSO4(s) + 2H2O(l) Esel = 2,1 V
Jika diisi (saat recharge), reaksi sel keseluruhan adalah:
PbSO4(s) + 2H2O(l) → Pb(s) + PbO2(s) + H2SO4 (aq)
Penggunaan : kendaraan bermotor, sumber energi, dsb.
Keuntungan : mampu menyediakan sumber energi yang lebih besar (sebagai starter), mempunyai waktu hidup relatif panjang, efektif pada suhu rendah.
Kerugian: (1) kapasitas dapat hilang: PbSO4 yang dibutuhkan saat tahap recharge, melapis lempeng baterai setelah baterai didischarge, terjadi pengurangan PbSO4. Apabila terus menerus terjadi maka makin hilang kapasitasnya, dan tidak dapat lagi diisi kembali. (2) Resiko keselamatan: sel yang sudah lama menimbulkan kerak dan dapat kehilangan air jika digunakan. Selama pengisian kembali, terkadang air akan terhidrolisis menghasilkan H2 dan O2, dimana dapat meledak jika disulut, dan kepercikan H2SO4. Baterai modern menggunakan paduan timbal (alloy Pb) untuk menghambat elektrolisis dan mengurangi kehilangan air, juga sel ditutup/diseal.
 Berbeda dengan baterai-baterai yang telah dibahas sebelumnya, baterai ini tidak menggunakan seng. Anoda yang digunakan adalah kadmium sedangkan katodanya adalah nikel. Baterai yang menggunakan elektrolit KOH ini dapat diisi ulang (diestrum) seperti aki. Baterai Ni-MH untuk pertama kalinya diawali dengan baterai nikel-kadmium (NiCad). Di anoda, setengah reaksi yang terjadi adalah oksidasi paduan logam (metal alloy), yakni mengabsorbsi hidrogen dalam alloy logam tersebut dalam elektrolit basa (KOH). Di katoda terjadi reduksi nikel(III) dalam bentuk NiO(OH).
Berbeda dengan baterai-baterai yang telah dibahas sebelumnya, baterai ini tidak menggunakan seng. Anoda yang digunakan adalah kadmium sedangkan katodanya adalah nikel. Baterai yang menggunakan elektrolit KOH ini dapat diisi ulang (diestrum) seperti aki. Baterai Ni-MH untuk pertama kalinya diawali dengan baterai nikel-kadmium (NiCad). Di anoda, setengah reaksi yang terjadi adalah oksidasi paduan logam (metal alloy), yakni mengabsorbsi hidrogen dalam alloy logam tersebut dalam elektrolit basa (KOH). Di katoda terjadi reduksi nikel(III) dalam bentuk NiO(OH).Reaksi di anoda:
MH(s) + OH-(aq) → M(s) + H2O(l) + e-
Reaksi di katoda:
NiO(OH)(s) + H2O(l) + e- → Ni(OH)2(s) + OH-(aq)
Reaksi sel keseluruhan:
MH(s)+ NiO(OH)(s) → M(s)+ Ni(OH)2(s) Esel= 1,4V
Untuk baterai NiCad reaksi yang terjadi sebagai berikut:
Di anoda:
Cd(s) + OH-(aq) → Cd(OH)2(s) + 2e-
Di katoda:
NiO2(s) + 2H2O(l) + 2e- → Ni(OH)2(s) + 2OH-(aq)
Reaksi sel keseluruhan:
Cd(s) + NiO2(s)→ Cd(OH)2(s) + Ni(OH)2(s)-
Reaksi sel bersifat dapat-balik selama pengisian kembali (recharging)
· Penggunaan: lampu blitz, power tools, dsb.
· Keuntungan : cukup ringan, bertenaga (relatif) besar, terhindar dari toksisitas kadmium (untuk baterai Nicad).
· Kerugian : penggunaan (baterai) tergantung pada penyimpanan.
Baterai ion-litium modern mempunyai anoda atom Li (litium) terinterkalasi (cairan antara) dengan bidang grafit [dinyatakan sebagai Lix(gr)]. Katodanya adalah litium-logam-oksida, misalnya LiMn2O4 dengan suatu eletrolit yang khas, yakni 1M LiClO4 dalam pelarut organik etilena karbonat. Elektron mengalir dalam suatu arus yakni ion Li+ mengalir dari anoda ke katoda.
Reaksi di anoda:
Lix(gr) → xLi+ + xe-
Reaksi di katoda:
Li1-xMn2O4(s) + xLi+ + xe- → LiMn2O4(s)
Reaksi sel keseluruhan:
Lix(gr)+ Li1-xMn2O4(s) → LiMn2O4(s) Esel=3,7 V
Reaksi sel dapat balik jika sel tersebut direcharge.
Penggunaan: baterai laptop, phone celluler, dsb.
Keuntungan: rasio energi/masa sangat ekstrem (tinggi);
1 mol elektron (1F) bisa dihasilkan kurang dari 7 gram logam (Mr Li = 6,941 g/mol)
Kerugian: relatif (lebih) mahal, pelarut organik terkadang dapat terbakar
Sel bahan bakar
Fuel cell (sel bahan bakar) menggunakan reaksi pembakaran yang menghasilkan arus listrik. Bahan bakarnya tidak terbakar, -sebagaimana halnya dengan jenis baterai yang lain-, tetapi reaksi berlangsung secara terpisah dalam sistem setengah-reaksi, dan elektron ditransfer melalui rangkaian eksternal. Suatu sel bahan bakar dihasilkan dari reaksi gas hidrogen dan oksigen mengahsilkan uap air. Gas hidrogen dioksidasi, sedang gas oksigen direduksi membentuk uap air. Elektroda yang digunakan adalah grafit yang dilingkupi (disalut) dengan katalis platina yang terimpregnasi.
Di anoda (akibat lapisan katalis), H2 displit, dan elektron (e-) masuk rangkaian. Dalam elektrolit terjadi pertukaran – membran – proton (proton-exchange-membrane, PEM) baru, di mana sel mengandung kerangka utama (backbone) polimer perfluoroetilena –[F2C – CF2]– yang diperkaya dengan gugus asam sulfonat (RSO3-) yang menjembatani (mengalirkan) H+ dari anoda ke katoda. Sedangkan di katoda (dengan cara yang analog, akibat lapisan Pt), terjadi reduksi terhadap O2, dan selanjutnya bergabung dengan H+.
Reaksi di anoda (Oksidasi):
H2(g) → 2H+(aq) + 2e-
Reaksi di katoda (Reduksi):
½O2(g) + 2H+(aq) + 2e- → H2O(g)
Reaksi sel keseluruhan (Redoks):
H2(g) + ½O2(g) → H2O(g)
Penggunaan : Sangat luas untuk masa yang akan datang, untuk transportasi, rumah
tangga, dan bisnis tenaga listrik. Dapat digunakan juga untuk menyediakan air murni (setelah dikondensasi terlebih dahulu) selama pembebasan hasil reaksinya.
Keuntungan :
(1) bersih, tidak menghasilkan polutan, dan portable
(2) mengkonversi ~ 75% energi ikat dalam bahan bakar menjadi energi listrik.
Kerugian :
(1) sel bahan bakar beroperasi dengan aliran kontinu dari reaktan, juga tidak mampu menyimpan energi listrik,
(2) katalis untuk elektroda cukup mahal
Sel bahan bakar merupakan sumber energi yang sangat menguntungkan. Tidak seperti sel kering (sel primer) dan sel penyimpan (sel sekunder), pereaksi di katoda dan anoda secara kontinu mensuplai kebutuhan energi. Sel ini bekerja selama ada reaksi itu dan tidak dapat menyimpan energi. Secara termodinamika, efisiensi yang dihasilkan relatif tinggi. Energi yang dihasilkan dalam bentuk kerja ini lebih tinggi daripada jika gas hidrogen dan gas oksigen dibakar untuk menghasilkan panas. Karenanya sumber bahan bakar merupakan energi masa depan dan dapat digunakan sebagai sumber energi alternatif pengganti bahan bakar fosil (minyak bumi dan sejenisnya).
Notasi sel
Notasi sel digunakan untuk menggambarkan rangkaian sel volta dan reaksi redoks yang berlangsung didalamnya. Secara umum, penulisan notasi sel volta menurut konvensi IUPAC adalah sebagai berikut.
Perhitungan Potensial sel
Kemampuan suatu elektrokimia untuk mendorong elektron mengalir melalui rangkaian luar disebut potensial sel (Esel). Potensial sel Volta dapat ditentukan dengan melihat data potensial reduksi suatu elektroda yang biasa disebut potensial elektroda (E0). Setiap atam memiliki harga potensial elektroda yang nilainya merupakan harga relatif terhadap potensial elektroda atom hidrogen yang berharga 0 Volt. Oleh karena itu, potensial atom hydrogen disebut juga potensial electrode standar. Jadi potensial elektroda standar adalah potensial elektroda yang diukur pada keadaan standar, yaitu pada konsentarsi 1M atau tekanan gas 1 atm dan umumnya pada suhu 250C.
2H+ (1M) + 2e- --> H2(g): E0 = 0 Volt
Menurut perjanjian, setiap unsur yang mengalami reaksi reduksi dengan hidrogen (hidrogen mengalami oksidasi), potensial reduksi unsur tersebut diberi tanda positif.
Untuk memudahkan, coba perhatikan data potensial reduksi beberapa logam yang terdapat pada tabel dibawah ini:

Diketahui : Fe2+ + 2e - --> Fe ;E0= -0,44 Volt
Ag+ + e- --> Ag ;E0=+0,80 Volt
Tentukan reaksi sel dan harga potensial selnya beserta persaman reaksinya dalam bentuk lambang sel?
Penyelesaian:
Unsur yang memiliki potensial reduksi yang lebih positif adalah Ag sehingga Ag mengalami reduksi, sedangkan unsur yang memiliki potensialj reduksi lebih negatif adalah Fe sehingga Fe mengalami oksidasi. Harga potensial elektroda tidak dikalikan denagan koefisien:
Fe(s) + 2e - --> Fe2+ ; E0= +0,44 Volt
2Ag+ + 2e- --> 2Ag(s) ; E0=+0,80 Volt
Jadi, reaksi sel : Fe(s) + 2Ag+ ---> Fe2+ + 2Ag(s)
Lambang Sel : Fe(s)׀ Fe2+ ׀׀ Ag+׀ Ag
Atau, dapat Pula Anda menghitung dengan menggunakan rumus:
E sel = E0katoda - E0kanoda
E sel = E0reduksi - E0oksidasi
E0reduksi = potensial reduksi zat yang mengalami reduksi
E0oksidasi = potensial reduksi zat yang mengalami oksidasi
Kegunaan potensial reduksi standar, E0, di tabel
Data E0 di tabel mempunyai kegunaan, tiga di antaranya adalah:
Semakin positif nilai E0, semakin bertambah daya oksidasi zat, atau zat merupakan oksidator yang baik. Sebaliknya, semakin negatif nilai E0, semakin bertambah daya reduksi zat, atau zat merupakan reduktor yang baik.
Ada dua cara yang dapat digunakan untuk menghitung E0sel menggunakan data E0 setengah sel di tabel, yakni:
Rumus yang digunakan adalah E0sel = E0katode – E0anode
dimana:
E0katode = potensial reduksi standar (E0) dari unsur tereduksi di katode
E0anode = potensial reduksi standar (E0) dari unsur teroksidasi di anode
Dengan cara menuliskan persamaan setengah reaksi oksidasi di anode dan reaksi reduksi di katode. Kemudian, menyertakan nilai E0 masing-masing. Tanda E0 di anode harus berlawanan dengan tanda yang diberikan pada tabel. Sedangkan tanda E0 di katode sesuai dengan di tabel. Nilai E0sel adalah jumlah E0sel di anode dan E0sel di katode. Koefisien tidak berpengaruh terhadapa E0sel. Hal ini karena E0 adalah sifat intensif yang nilainya tidak tergantung pada jumlah zat dalam reaksi.
Anode:........................→........................+ne- E0 = -(E di tabel)
Katode: ..............+ ne- → ...................... E0 = (E di tabel) +
Dengan memperhatikan data E0 di tabel maka untuk memperkirakan spontan atau tidaknya suatu reaksi adalah
Deret Volta
Pada tahun 1825 Alessandro Giuseppe Volta menyusun urutan logam-logam berdasarkan sifat reduktor, dari yang terkuat sampai yang terlemah. Seperti Anda ketahui bahwa semua logam memiliki sifat reduktor. Volta menyusun kekuatan sifat konduktor ini berdasarkan eksperimen. Sususnan kekuatan sifat reduktor ini sekarang dikenal sebagai deret Volta. Jadi deret Volta merupakan urutan unsur-unsur yang disusun berdasarkan data potensial reduksi. Berikut beberapa unsur yang dapat dihapal berdasarkan urutan potensial reduksinya.
Di kelas X kalian telah mengenal reaksi redoks dan penyetaraan reaksi redoks sederhana. Di kelas XII kalian akan melakukan penyetaraan reaksi redoks yang lebih kompleks dan sel elektrokimia di mana reaksi redoks digunakan untuk menghasilkan arus listrik atau sebaliknya. Ada dua jenis sel elektrokimia, yaitu sel volta (sel galvani) dan sel elektrolisis.
Reaksi redoks adalah reaksi kimia yang disertai perubahan bilangan oksidasi atau reaksi yang di dalamnya terdapat serah terima elektron anatar zat. Reaksi redoks sederhana dapat disetarakan dengan mudah tanpa metode khusus, seperti yang telah dijelaskan di kelas X. akan tetapi untuk reaksi yang cukup kompleks, ada dua metode yang dapat digunakan untuk meyetarakannnya, yaitu:
Penentuan bilangan oksidasi
Secara umum, digunakan untuk dua atom yang berikatan (secara ionik maupun kovalen), yaitu
Berikut aturan penentuan bilangan oksidasi suatu atom unsur:
- Bilangan oksidasi dalam unsur bebas = nol
Contoh: bilangan oksidasi atom dalam unsur Na, Fe, C, H2, Cl2, P4 = 0
- Bilangan oksidasi ion monoatom = muatan ionnya.
Contoh: bilangan oksidasi ion Cu2+ = +2
bilangan oksidasi ion F- = -1
- Jumlah bilangan oksidasi atom-atom dalam senyawa netral = 0. Sedangkan jumlah bilangan oksidasi atom-atom dalam ion poliatom = muatan ionnya.
Contoh:
· Senyawa NH3 muatan = 0
Jumlah biloks N + jumlah biloks H = 0
1 atom N x b.o N + 3 atom H x b.o H = 0
· Ion poliatom PO43- muatan = -3
Jumlah biloks P + jumlah biloks O = -3
1 atom P x b.o P + 4 atom O x b.o O = -3
- Bilangan oksidasi fluorin (F) dalam senyawanya selalu = -1.
Contoh: biloks F dalam NaF, HF, ClF3 = -1
- Bilangan oksidasi hidrogen (H) jika berikatan dengan non-logam = +1. Sedangkan bilangan oksidasi H jika berikatan dengan logam adalah -1.
Contoh: biloks H dalam HF, HCl, H2O = +1
biloks H dalam LiH, CaH2 = -1
- Bilangan oksidasi oksigen (O) dalam senyawanya = -2, kecuali dalam senyawa biner fluorida, peroksida, dan superoksida.
Contoh: biloks O dalam H2O = -2
biloks O dalam senyawa OF2 = +2
biloks O dalam senyawa H2O2 = -1
biloks O dalam senyawa KO2, CsO2 = - 1/2
- Bilangan oksidasi logam IA (Li, Na, K, Rb, Cs, Fr) dalam senyawanya =+1
- Bilangan oksidasi logam IIA (Be, Mg, Ca, Sr, Ba) dalam senyawanya = +2
- Bilangan oksidasi logam transisi dalam senyawanya dapat lebih dari satu.
Contoh: Cu dapat mempunyai biloks +2 dalam CuO, +4 dalam Cu2O.
- Bilangan oksidasi nonlogam
· Dalam senyawa biner dari logam dan nonlogam, nonlogam yang mempunyai biloks = muatan ionnnya.
Contoh: Cl dalam NaCl mempunyai biloks = -1
· Dalam senyawa biner dari nonlogam dan nonlogam, nonlogam yang lebih elektronegatif mempunyai biloks negatif. Nilai biloksnya = biloks jika nonlogam tersebut berada sebagai ionnya.
Contoh: dalam IF, nilai biloks F negatif karena F lebih elektronegatif dibandingkan I. nilai biloks F = biloks ion F- yakni -1
1. Metode bilangan oksidasi
Prinsip dasar metode ini adalah jumlah kenaikan bilangan oksidasi dari reduktor (zat yang teroksidasi) sama dengan jumlah penurunan bilangan reduksi dari oksidator (zat yang tereduksi). Untuk menyetarakan persamaan redoks dengan metode ini, harus ditempuh langkah-langkah sebagai berikut:
- Tulislah bilangan oksidasi setiap unsur untuk mengetahui unsur mana yang mengalami perubahan bilangan oksidasi.
- Setarakan jumlah unsur yang mengalami perubahan bilangan oksidasi antara ruas kiri dengan ruas kanan dengan menambah koefisien yang tepat.
- Tentukan jumlah berkurang dan bertambahnya bilangan oksidasi.
- Setarakan jumlah perubahan jumlah bertambah dan berkurangnya bilangan oksidasi tersebut dengan memberi koefisien yang sesuai.
- Setarakan unsur-unsur yang lainnya dalam urutan kation, anion, hidrogen, dan terakhir oksigen (KAHO).
Untuk lebih jelasnya, perhatikanlah contoh berikut:
Setarakan reaksi berikut dengan metode bilangan oksidasi:
2. Metode setengah reaksi atau metode ion elektron
Prinsip dasar metode setengah reaksi adalah pemisahan reaksi oksidasi dan reaksi reduksi dalam reaksi redoks. Masing-masing reaksi tersebut dinamakan setengah reaksi oksidasi dan setengah reaksi reduksi. Kedua reaksi ini kemudian disetarakan secara terpisah, sebelum digabungkan kembali untuk memperoleh persamaan reaksi redoks yang sudah setara secara keseluruhan.
Ada beberapa hal yang perlu diperhatikan pada metode ini, yaitu:
Metode setengah reaksi digunakan untuk reaksi redoks yang memiliki persamaan reaksi ionik dimana serah terima elektron digambarkan dengan jelas. Pembahasan metode ini, dibagi menjadi dua kondisi, yaitu untuk suasana asam dan suasana basa atau netral.
a. Reaksi redoks untuk larutan asam
Penyetaraan reaksi redoks untuk kondisi asam dilakukan dengan penambahan ion H+. Untuk menyetarakan persamaan redoks pada suasana asam, harus ditempuh langkah-langkah sebagai berikut:
1. Tulislah bilangan oksidasi setiap unsur untuk mengetahui unsur mana yang mengalami perubahan bilangan oksidasi.
2. Tulislah kerangka setengah reaksi reduksi dan oksidasinya.
3. Setarakan jumlah unsur yang mengalami perubahan bilangan oksidasi antara ruas kiri dengan ruas kanan dengan menambah koefisien yang tepat.
4. Setarakan oksigen (O) dengan menambahkan H2O ke ruas yang kekurangan O
5. Setarakan hidrogen (H) dengan menambahkan H+ ke ruas yang kekurangan atom H
6. Setarakan muatan dengan menambahakan elektron (e-) ke ruas yang meuatannya lebih positif
7. Samakan jumlah elektron pada reaksi reduksi dan oksidasi
Untuk lebih jelasnya, perhatikanlah contoh berikut:
Setarakan reaksi berikut dengan metode setengah reaksi:
Cu(s) + NO3-(aq) + H+(aq) → Cu2+(aq) + NO2 (g) + H2O (l)
Jawab:
Langkah 1, tulislah bilangan oksidasi setiap unsur untuk mengetahui unsur mana yang mengalami perubahan bilangan oksidasi.
Langkah 2, tulislah kerangka setengah reaksi reduksi dan oksidasinya.
Reduksi: NO3- → NO2
Oksidasi: Cu → Cu2+
Langkah 3, setarakan jumlah unsur yang mengalami perubahan bilangan oksidasi antara ruas kiri dengan ruas kanan dengan menambah koefisien yang tepat.
Karena jumlah atom N dan Cu sudah setara, tidak ada yang perlu dilakukan
Reduksi: NO3- → NO2
Oksidasi: Cu → Cu2+
Langkah 4, setarakan oksigen (O) dengan menambahkan H2O ke ruas yang kekurangan O
Reduksi: NO3- → NO2 + H2O
Oksidasi: Cu → Cu2+
Langkah 5, setarakan hidrogen (H) dengan menambahkan H+ ke ruas yang kekurangan atom H
Reduksi: 2H+ + NO3- → NO2 +H2O
Oksidasi: Cu → Cu2+
Langkah 6, setarakan muatan dengan menambahkan elektron (e-) ke ruas yang muatannya lebih positif.
· Pada reaksi reduksi, muatan ruas kiri = 1 x (muatan NO3-) = 1x (3-) =3-
Muatan ruas kanan = 2 x (muatan H+) = 2 x (1+) = 2+
Jadi, muatan ruas kiri (3-) dan ruas kanan (2+) dapat disetarakan dengan penambahan 1 e- di ruas kanan.
· Pada reaksi oksidasi, muatan ruas kiri = 0
Muatan ruas kanan = (muatan Cu2+) = 2-
Jadi, muatan ruas kiri (0) dan ruas kanan (2-) dapat disetarakan dengan penambahan 2 e- di ruas kiri.
Reduksi: H2O + NO3- → NO2 +2H+ + e-
Oksidasi: 2e- + Cu → Cu2+
Langkah 7, Samakan jumlah elektron pada reaksi reduksi dan oksidasi dengan perkalian silang atau jika jumlah elektron pada reaksi reduksi dan oksidasi adalah kelipatan, maka gunakan faktor terkecil. Lalu, jumlahkan kedua setengah reaksi tersebut.

Jadi, persamaan yang diperoleh adalah
2H2O + 2NO3- + Cu → 2NO2 + 4H+ + Cu2+
b. Reaksi redoks untuk larutan basa atau netral
Penyetaraan reaksi redok untuk larutan basa atau meta sama dengan larutan asam. Langkah 1-7 untuk larutan asam masih berlaku. Kita hanya perlu menambahkan langkah ke 8 dan 9,yaitu penambahan OH- dan perolehan total reaksi redoks. Untuk menyetarakan persamaan redoks pada suasanabasa, harus ditempuh langkah-langkah sebagai berikut:
1. Tulislah bilangan oksidasi setiap unsur untuk mengetahui unsur mana yang mengalami perubahan bilangan oksidasi.
2. Tulislah kerangka setengah reaksi reduksi dan oksidasinya.
3. Setarakan jumlah unsur yang mengalami perubahan bilangan oksidasi antara ruas kiri dengan ruas kanan dengan menambah koefisien yang tepat.
4. Setarakan oksigen (O) dengan menambahkan H2O ke ruas yang kekurangan O
5. Setarakan hidrogen (H) dengan menambahkan H+ ke ruas yang kekurangan atom H
6. Setarakan muatan dengan menambahakan elektron (e-) ke ruas yang meuatannya lebih positif
7. Samakan jumlah elektron pada reaksi reduksi dan oksidasi
8. Menambahkan OH- di ruas kiri dan kanan. Jumlah OH- harus sama dengan jumlah H+ yang ada. OH- dan H+ membentuk H2O.
9. Periksa apakah ada spesi yang sama di ruas kiri dan kanan. Jika ada,kurangi jumlah spesi yang lebih besar dengan yang lebih kecil.
Untuk lebih jelasnya, perhatikanlah contoh berikut:
Setarakan reaksi berikut dengan metode setengah reaksi:
Au (s) + CN-(aq) +O2(g)→ Au(CN)4- (aq) +OH- (aq)
Jawab:
Langkah 1, tulislah bilangan oksidasi setiap unsur untuk mengetahui unsur mana yang mengalami perubahan bilangan oksidasi.
Langkah 2, tulislah kerangka setengah reaksi reduksi dan oksidasinya.
Reduksi: Au → Au2+
Oksidasi: O2→ OH-
Langkah 3, setarakan jumlah unsur yang mengalami perubahan bilangan oksidasi antara ruas kiri dengan ruas kanan dengan menambah koefisien yang tepat.
Reduksi: Au → Au2+
Oksidasi: O2→ OH- (tidak ada)
Langkah 4, setarakan oksigen (O) dengan menambahkan H2O ke ruas yang kekurangan O
Reduksi: Au → Au2+
Oksidasi: O2→ OH- + H2O
Langkah 5, setarakan hidrogen (H) dengan menambahkan H+ ke ruas yang kekurangan atom H
Reduksi: Au → Au2+
Oksidasi: 3H++O2→ OH- + H2O
Langkah 6, setarakan muatan dengan menambahkan elektron (e-) ke ruas yang muatannya lebih positif.
· Pada reaksi reduksi, muatan ruas kiri = 0
Muatan ruas kanan = 1 x (muatan Au2+) =1 x (2+) = 2+
Jadi, muatan ruas kiri (0) dan ruas kanan (2+) dapat disetarakan dengan penambahan 2 e- di ruas kanan.
· Pada reaksi oksidasi, muatan ruas kiri = 3 x (muatan H+) =3 x (1+) = 3+
Muatan ruas kanan = 1x (muatan OH-) = 1x (1-) = 1-
Jadi, muatan ruas kiri (3+) dan ruas kanan (1-) dapat disetarakan dengan penambahan 4 e- di ruas kiri.
Reduksi: Au → Au2+ + 2e-
Oksidasi: 4e- +3H++O2→ OH- + H2O
Langkah 7, Samakan jumlah elektron pada reaksi reduksi dan oksidasi dengan perkalian silang atau jika jumlah elektron pada reaksi reduksi dan oksidasi adalah kelipatan, maka gunakan faktor terkecil. Lalu, jumlahkan kedua setengah reaksi tersebut.
Langkah 8, Menambahkan OH- di ruas kiri dan kanan. Jumlah OH- harus sama dengan jumlah H+ yang ada. OH- dan H+ membentuk H2O.
Reaksi redoks: 3OH- + 2Au + 3H+ + O2→ 2Au2+ + OH-+ H2O + 3OH-
Reaksi redoks: 3H2O + 2Au + O2→ 2Au2+ + H2O + 4OH-
Langkah 9, Periksa apakah ada spesi yang sama di ruas kiri dan kanan. Jika ada,kurangi jumlah spesi yang lebih besar dengan yang lebih kecil.
Reaksi redoks: 3H2O + 2Au + O2→ 2Au2+ + H2O + 4OH- (tidak ada)
Jadi, persamaan yang diperoleh adalah
3H2O + 2Au + O2→ 2Au2+ + H2O + 4OH-




























Banyak sekali materinya
BalasHapusAnjay
HapusNgeri ngeriii
HapusBanyak sekali materinya
BalasHapusBisa dipersingkat ga si wkwk
BalasHapusKurang panjang materinya tanggung wkwkw
BalasHapusPasti jarang yang baca sampe bawah !!
BalasHapusPanjang banget materinya, bikin males baca. Wkwkwkwkwk
BalasHapusYo yo ayo
BalasHapusWao
BalasHapusJangan joosss le..
BalasHapusYeay
BalasHapusYeay
BalasHapusMalesee
BalasHapusKamu nanti saya panggil ke ruang Waka menemui kepala ya nak.
HapusSemangateeee
BalasHapusSemangate kurang banyak materinya kalau bisa 1 buku sekalian
BalasHapusKurang banyak kak
BalasHapusNjir
HapusAku hanya bisa berkata "Gils Panjang Sekali"
BalasHapusTetapi terimakasih untuk admin yg sudah membuatnya
Sangat membantu sekali ;)
Oke kamu mantap
BalasHapusSangat membantu
BalasHapusSangat membantu
BalasHapusWeh
BalasHapusSat
HapusNice
BalasHapuscaraku mending ngga usah belajar aja ngga papa
BalasHapusminimal kalau kasih materi dipersingkat ya kack
BalasHapus#kimia_mudah...👌
BalasHapus#kimia_mudah..👌
BalasHapusSemoga yang baca masuk surga aamiin,,,,,, #KIMIA_MUDAH #PAK_TOYIBI_SEHAT_SELALU
BalasHapusAfdhal fauzan I LOVE YU
BalasHapus#kimia_easy Kenyataan nya ga begitu tapi oke lah
BalasHapussaran saya kedepannya lebih bagus lagi okehhhh.
BalasHapus